Flore intestinale et prise de poids à l’arrêt du tabac
On perd du poids quand on se met à fumer, on en prend si l’on arrête. Entre temps, la perte initiale se stabilise, et la courbe de poids du fumeur en fonction de l’âge est parallèle à un niveau inférieur à celle du non-fumeur. À l’arrêt, on retrouve en moyenne le poids qu’on aurait eu au même âge si l’on n’avait pas fumé. Mais certains maigrissent, d’autres prennent un poids très excessif, comme le montre sur une population française un sondage du forum www.atoute.org (Tableau I).
[(image|=={image}|et{|non}|oui)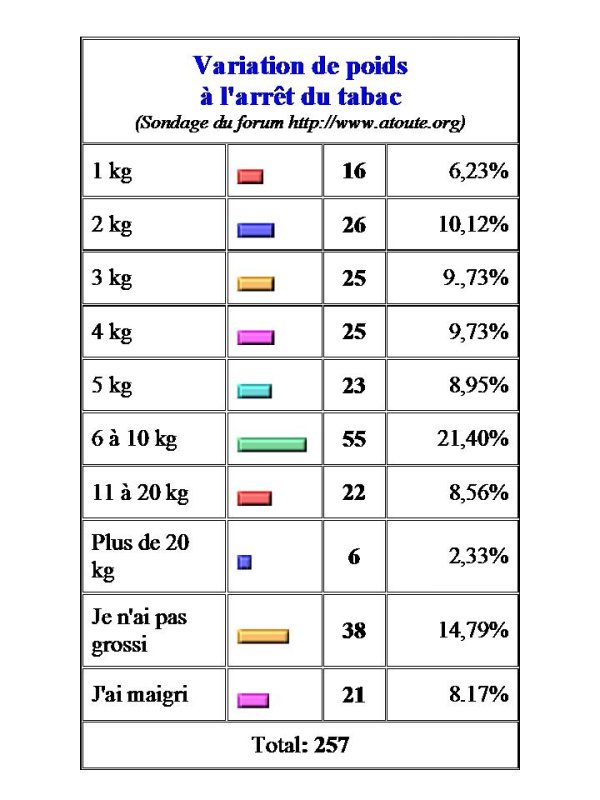 ][(image|=={image}|et{|oui}|oui)
][(image|=={image}|et{|oui}|oui)
- D. Chapelot dans son cours du DIU de Tabacologie fait une excellente analyse de ce phénomène et de ses mécanismes métaboliques et hormonaux [1]. En gros, la nicotine stimule la dépense d’énergie. Elle fait sécréter de l’adrénaline par la médullosurrénale, de la noradrénaline par les terminaisons sympathiques. Ces catécholamines libérent du glucose dans le sang à partir du glycogène hépatique, et inhibent la sécrétion d’insuline. De plus, elles favorisent la dégradation des graisses stockées en acides gras et glycérol. Donc tout est fait pour augmenter le catabolisme et diminuer le stockage dans les graisses. On dépense plus, mais on mange moins. La cigarette est connue comme « coupe-faim » et, dans les camps de concentration, certains échangeaient un peu de leur maigre ration contre des cigarettes.
Une nouvelle hypothèse : la flore intestinale
Une équipe danoise a montré que chez les obèses, la flore intestinale est moins abondante et plus pauvre en gènes que chez les sujets normaux. Ces modifications sont parallèles à l’insulino-résistance et à la dyslipidémie, avec évidemment de grandes variations individuelles [2]. Soumis à un régime restrictif, des obèses augmentent leur flore intestinale, qui s’enrichit en germes mieux équipés enzymatiquement [3].
Un travail suisse a porté sur les modifications du microbiote (variété et abondance de la flore) et du microbiome (arsenal génétique des germes) chez 10 sujets arrêtant de fumer [4]. Ils étaient observés une semaine avant l’arrêt puis sur une durée de 8 semaines, avec un bilan à 4 et 8 semaines. Les témoins étaient 5 fumeurs continuant à fumer et 5 non-fumeurs.
Le poids et la flore des témoins sont restés stables. Ceux qui ont arrêté de fumer ont pris en moyenne 2,2 kg, sans modifications de leur prise alimentaire, tant en calories qu’en diversité. Leur flore s’est modifiée, avec augmentation des Firmicutes et Actinobacteria, et diminution des Bacterioidetes et Proteobacteria. La diversité intra-espèces augmente. Une différence éventuelle entre la composition en germes de l’iléon et du recto-sigmoïde n’a pu être étudiée. C’eût été intéressant compte tenu que la maladie de Crohn est aggravée par le tabagisme, qui améliore au contraire la colite ulcéreuse ou le colon irritable.
Les auteurs suggèrent que la modification de flore et son enrichissement génétique puissent rendre assimilables certains nutriments potentiels habituellement excrétés et expliquer une partie de la prise de poids. Cependant les obèses ont une richesse bactérienne plutôt basse, quand la diminution des Bacterioidetes et l’augmentation des Firmicutes est commune aux deux groupes. Toute interprétation formelle est donc prématurée, en attendant la reproduction de ces résultats.
Commentaires
Une première hypothèse verrait les modifications de la flore comme conséquence d’une modification de l’alimentation à l’arrêt du tabac. Mais il n’a pas été relevé de différence alimentaire par rapport aux témoins, tant en nombre de calories qu’en composition, et l’augmentation de la prise d’alcool n’a été que de 36 calories par jour. C’est tout à fait en accord avec l’observation que, bien que les animaux germ-free consomment davantage d’une même nourriture, leur poids est inférieur à celui animaux normaux [5]. Ceux-ci profiteraient donc des capacités de dégradation par leurs germes intestinaux de cellulose, pectines et autres molécules que n’attaquent pas leurs enzymes digestifs.
De plus, l’interrogatoire est une méthode imprécise, et les relevés ne portent que sur 2 groupes de 10 sujets. Il peut passer à côté de modifications subtiles, comme le retour du goût pour le sucré et les légumes et à une alimentation moins carnée que chez les fumeurs, qui pourrait modifier le terrain dans un sens plus favorable à certains germes [6].
.
Chez le rat dont la croissance est continue, l’administration chronique de nicotine provoque une perte de poids initiale, puis la courbe de poids suit à un niveau inférieur celle des témoins, qu’elle rejoint à l’arrêt de l’exposition. Il y a donc une adaptation, parallèle à ce qui est observé chez l’Homme.
La levée d’une action des toxiques de la fumée directement sur les germes ou sur la muqueuse qui les héberge, qu’il s’agisse de nicotine, d’oxyde de carbone ou d’autres, pourrait être une autre explication de la modification de la flore. Les effets du tabagisme sur les colopathies plaident pour une telle hypothèse. Il faudrait alors observer une différence de flore entre fumeurs et non fumeurs sur un nombre suffisant de sujets. Elle n’a pas été constatée dans l’étude, mais sur deux groupes témoins de 5 sujets seulement, et pourrait être masquée par une adaptation.
Il ne s’agit donc que d’un premier travail, avec beaucoup de contradictions. C’est une approche nouvelle très intéressante pour comprendre la prise de poids à l’arrêt du tabac. Mais le sujet intéresse beaucoup plus ceux qui s’intéressent à l’énorme marché de l’obésité. C’est dire les conflits d’intérêt qui risquent de biaiser les publications sur les lactobacilles, comme le fait remarquer une revue générale [7]
[2] Le Chatelier E et al. Richness of human gut microbiome correlates with metabolic markers. Nature (2013) ; 500 : 541-546.
[3] Cotillard A. et al. Dietary intervention impact on gut microbial gene richness. Nature (2013) ; 500 : 583-588.
[4] Biedermann L et all. Smoking cessation induces profound changes in the composition of the intestinal microbiota in humans. PLoS One. (2013) ;8(3):e59260. doi : 10.1371/journal.pone.0059260. Epub 2013 Mar 14.
[5] Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI
The gut microbiota as an environmental factor that regulates fat storage.
Proc Natl Acad Sci U S A. (2004) ; 101(44):15718-23.
[7] Angelakis E, Armougom F, Million M, Raoult D. The relationship between gut microbiota and weight gain in humans. Future Microbiol (2012) 1:91-109